Транспорт пептидов
Многие из этих пептидов находятся в нервных окончаниях и транспортируются к синапсам с помощью аксоплазматического тока. Субклеточное распределение нейротензина, соматостатина, ангиотензина, субстанции Р, вазопрессина и окситоцина характеризуется их преимущественным связыванием с синаптосомами, выделенными из различных внегипоталамических образований головного мозга [Larner J., 1977; Kobayashi R. M. et al., 1977; Bury R. W. et al., 1977].
Это связывание является высокоспецифичным, обратимым и насыщаемым. Структура пептидных гормонов после их связывания с синаптическими мембранами либо не нарушается, как, например, у нейротензина [Kitabgi P. et al., 1977], либо протерпевает отчетливые изменения (в частности, АКТГ), подвергаясь воздействию протеаз.
Большой интерес вызывают данные о том, что пептидные гормоны могут оказывать непосредственное влияние на возбудимость структур ЦНС, имеющих прямое отношение к обучению и памяти (гиппокамп, миндалевидный комплекс, гипоталамус, ростральные отделы ретикулярной формации среднего мозга). В нашей лаборатории исследовали характер влияния некоторых пептидных гормонов на возбудимость лимбических образований головного мозга и гипоталамуса [Лосев Н. А. и др., 1971; Бородкин Ю. С. и др., 1972]. В условиях острого эксперимента на кроликах с электродами, введенными в дорсальный гиппокамп, медиальные ядра перегородки, паравентрикулярное и супраоптическое ядра, установлено, что окситоцин повышает возбудимость этих структур при внутривенном введении и при локальной микроинъекции.
Сходный эффект наблюдали также при повторной электрической стимуляции паравентрикулярных и супраоптических ядер гипоталамуса, в которых синтезируются окситоцин и вазопрессин.
 |
Влияние повторных предварительных раздражений паравентрикулярного (а) и супраоптического (б) ядер на возбудимость дорсального гиппокампа: Заштрихованная часть — средняя величина порогов гиппокампальных разрядов последействия из 5 экспериментов в контроле и опыте с доверительными границами при Р<0,05. По оси абсцисс — номера раздражений; по оси |
АКТГ повышал возбудимость дорсального гиппокампа и вентромедиалыюй части миндалевидного комплекса, в то время как глюкокортикоиды (гидрокортизон и дексаметазон), напротив, значительно снижали их возбудимость [Сапронов Н. С, 1975].
Ангиотензин II значительно увеличивал частоту спонтанных импульсных разрядов при микроионофоретическом подведении его к нейронам соматосенсорной и зрительной коры больших полушарий и нейронам переднего гипоталамуса [Судаков К. В. и др., 1976]. Воздействие ангиотензина II на сому этих нейронов вызывало обратимую деполяризацию мембраны.
Сходные данные получены D. Felix с соавт. (1977): ангиотензин II активировал нейроны субфорникального органа у кошек. Фрагмент ангиотензина II — гептапептид, занимающий положение 2—8 в его молекуле, также повышал возбудимость нейронов. Стимулирующие эффекты обоих соединений устранялись специфическим антагонистом ангиотензина II — саралазином.
D. Felix и W. Schlegel проанализировали влияние различных фрагментов ангиотензина II на возбудимость нейронов. Установлено, что наибольшей активностью обладает тетрапептид, занимающий положение 5—8 в его молекуле, тогда как трипептид, занимающий положение 6—8, на активность нейронов не влияет. На этом основании авторы предположили, что в головном мозге имеются специфические рецепторы, чувствительные к ангиотензину II.
Соматостатин и субстанция Р, обнаруженные в первичных афферентных нейронах спинного мозга, регулируют уровень возбудимости спинальных нейронов, участвующих в восприятии болевых импульсов [Henry J. L., 1975; Hokfelt Т. D. et al, 1977].
Энкефалины и эндорфины повышают возбудимость пирамидных нейронов гиппокампа за счет торможения промежуточных нейронов [Zieglgangsberger W. et al., 1979]. Они также подавляют активность промежуточных спинальных нейронов типа Рэншоу [Nicoll Я. А., 1978].
«Нейрохимические и функциональные основы долговременной памяти»,
Ю.С. Бродкин, Ю.В. Зайцев
Влияние АКТГ на долговременную память также зависит от дозы и времени его введения. Так, по данным R. L. Cold и К. В. van Buskirk (1976), введенный в дозе 0,03—0,3 ME, он увеличивал время сохранения пассивного навыка избегания у крыс, а в дозе 3—10 ME вызывал ретроградную амнезию Стимулирующие эффекты АКТГ независимо от дозы проявлялись сильнее…
Сходное с АКТГ влияние на память и обучение животных оказывает α-меланоцитстимулирующий гормон, структура которого близка к отдельным фрагментам АКТГ: он ускоряет обучение [Paterson А. Т., 1975], значительно увеличивает время хранения закрепленных навыков активного и пассивного избегания электрошока у крыс и облегчает их воспроизведение [Веckwitt В. Е. et al, 1977]. Нужно отметить, что АКТГ, его отдельные…
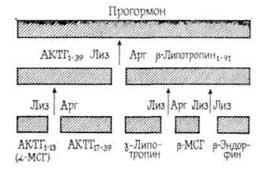
Необходимо отметить, что активным влиянием на память обладают не целые молекулы пептидных гормонов, а в основном их отдельные фрагменты, характеризующиеся специфической последовательностью аминокислот. Следовательно, можно предположить, что эти фрагменты образуются в организме в процессе активного метаболизма пептидных гормонов под влиянием протеолитических ферментов [Чипенс Г. И. и др., 1975]. Интимный механизм пептидных гормонов окончательно не выяснен,…
Совсем недавно Н. Н. Zing и Y. С. Patil (1979) выделили из срединного возвышения и нейрогипофиза крыс два высокомолекулярных белка с относительной молекулярной массой 25 000 и 40 000, обладающих иммунореактивностью кс оматостатину и высвобождающихся при деполяризации нейронов. Авторы предполагают, что один из этих белков является предшественником соматостатина, который синтезируется на рибосомах, высвобождается, а затем…
Многие пептидные гормоны передней доли гипофиза и гипоталамические рилизингфакторы являются субстратами для карбоксиметилтрансферазы, наиболее активной в головном мозге [Diliberto E. J. et al., 1976; Egger D. H. et ai., 1976]. Данный фермент переносит СН3-группу S-аденозилметионина на карбоксильные группы белков, в частности эндогенных акцепторных белков. В результате отрицательный заряд на белке нейтрализуется и становится подвижным (метиловые…
